葉緑体機能と個体統御
共立出版『蛋白質核酸酵素』2000年2月号p.147-152から出版社の許可を得て転載
佐藤文彦
要約: 葉緑体は炭素・窒素・硫黄同化や脂質合成など種々の重要な生体成分の生合成に関与している。従って,内的・外的環境変動による葉緑体の機能発現の変化は生育に大きな影響を及ぼすが,過剰の環境変動(ストレス)による葉緑体機能の損傷は葉緑体のみならず,細胞あるいは個体の死に至る。一方,葉緑体は一次代謝の場であるとともに,植物ホルモンの生合成の場でもあることから,代謝調節とは異なる経路(シグナル)により個体機能の統御に関与している可能性がある。ここでは最近の話題を含め,これら葉緑体機能と細胞分化の関係について紹介する。
key words: 細胞分化,葉緑体分化,タンパク質分解
はじめに
葉緑体は炭素同化はいうに及ばず窒素や硫黄同化(図1参照)など植物の無機元素同化の中心を成すオルガネラである。また,脂質合成の場でもある。従って,これらの機能を阻害することは植物の代謝,さらにはその生育を大きく阻害することになる。これらの機能は植物に特有であることから,葉緑体機能をターゲットとするさまざまな除草剤が合成され,利用されている1)。例えば,光合成的電子伝達系を阻害するアトラジンや窒素同化の要であるグルタミン合成酵素を阻害するバスタ(ビアラフォス),脂肪酸合成の重要な酵素であるアセチルCoAカルボキシラーゼ阻害剤2)は重要な除草剤である。もちろん,自然環境下においても養分欠乏や乾燥,塩集積,低温など種々の環境ストレスにより葉緑体機能が損なわれ,植物の生長が抑制されることはよくある。しかし,植物の生長が損なわれるのは,単に一次代謝の停止(生合成や呼吸基質の不足)のみによるのではない。ここでは,葉緑体機能が植物の細胞分化に及ぼす影響について紹介する。
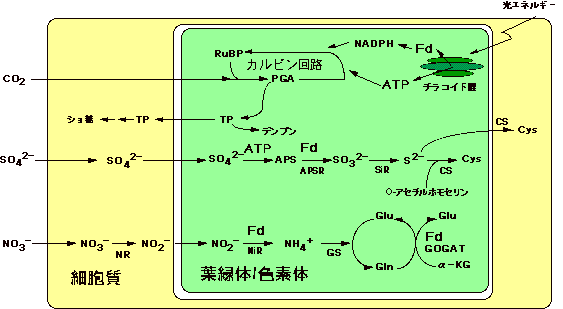
図1 葉緑体内で生成されるATPとFd(還元型フェレドキシン)を用いて無機炭素・窒素・硫黄の同化が行われる。
APS, アデノシン 5'ホスホ硫酸; APSR, APSリダクターゼ; α-KG, ケトグルタル酸; CS, システイン合成酵素; GOGAT, グルタミン酸合成酵素; GS, グルタミン合成酵素; NiR, 亜硝酸還元酵素; NR, 硝酸還元酵素; PGA, フォスフォグリセリン酸;
SiR, 亜硫酸還元酵素; TP, トリオースリン酸
葉緑体機能と葉緑体分化
葉緑体という名が示すように,葉緑体は緑色色素(クロロフィル)を含み光のエネルギーを固定するが,植物によっては白い葉,斑入りのものがある。これら白色の細胞・組織では葉緑体の分化が阻害されている。クロロフィルやカロチノイドなど直接的な色素生合成遺伝子の変異3-5)の他に,寄生植物Epifagus virginianaにおける葉緑体遺伝子(RNA polymerase subunits)の欠損や,核コードの葉緑体関連遺伝子(葉緑体内での転写・翻訳系やRubisco Sサブユニットのような構成タンパク質,さらにはSRPのような輸送に関わる遺伝子等)に問題がある場合の両方が知られている6-9)。いずれの場合も遺伝的変異により葉緑体機能の発現が不完全となることにより,葉緑体の分化が抑制される。これらの因子の発現抑制が葉緑体の分化の抑制,葉の白化を引き起こすことは形質転換植物を用いた実験により確かめられている10)。また,熱処理による葉緑体リボゾームの失活によっても同様の現象が認められる7)。
一方,葉緑体の分化抑制における要因としては,光合成機能に必要な因子のアッセンブリの阻害とともに,光合成機能の不全による傷害(光酸化的ストレス)の誘導も挙げることができる。カロチノイドはクロロフィルの補助集光因子であるとともに,過剰の光エネルギーを発散する役割を持つが,その生合成阻害は光化学系のアッセンブリの阻害とともに,過剰の光エネルギーによる傷害をもたらし,葉緑体を白化させる。同様に,強光,乾燥,塩害,低温などの環境ストレスは通常のプロセス(炭酸同化や非光化学的プロセス等)による光エネルギーの発散では消費しきれない光エネルギーの増大により,葉緑体内に内在する消去系の能力を上回る活性酸素を生じ,葉緑体を破壊する。したがって,この場合の白化は厳密には葉緑体分化の阻害とはいえないが,人為的に活性酸素消去系を抑制した植物11)や,温度感受性のアスコルビン酸還元酵素を持つ植物12)では,枯死には至らない葉緑体の分化抑制,白化が認められることより,このような光酸化的ストレスも葉緑体分化抑制の機構の一つと考えられる。逆に,ポリオール類のようなハイドロキシラジカルを消去する化合物13)や活性酸素を解毒(不均化)するカタラーゼ14)の導入はストレス下にある葉緑体機能を保護し,植物体の白化を防ぎ,ストレス耐性を高めることが明らかとなっている。
葉の白化は上述のように葉緑体機能の発現の抑制や阻害によって引き起こされるが,植物が自ら,葉緑体機能を停止する場合がある。開花・結実により下位葉が枯れ上がる老化現象や葉緑体から他の機能をもつ色素体(クロモプラストやアミロプラスト)への変換においては,もともと存在したタンパク質の分解が必須である。特に,老化は蓄えた養分を生殖器官に転流する重要なプロセスである15,16)。
老化における転流では,特に,葉緑体の可溶性タンパク質の50%を占め,炭酸固定をになっているRibulose-bisphosphate carboxylase/oxygenase(Rubisco)の分解が重要である。これまで,Rubiscoの分解については,活性酸素による分解,プロテアーゼの関与などいくつかの仮説が発表されている17,18)が,いまだにその最終分解過程については判明していない。実のところ,葉緑体の中におけるプロテアーゼの研究は輸送されるタンパク質のプロセッシング酵素や光傷害におけるD1タンパク質の分解が中心であり,老化や葉緑体の機能転換に伴うプロテアーゼについての研究は余り進んでいない19,20)。
我々は,葉緑体DNA結合タンパク質というまったく違う方向の研究からこの老化に伴う葉緑体の機能変換に関与するかもしれないと考えられる遺伝子CND41(Chloroplast nucleoid-DNA binding protein of 41kD)を単離した。CND41はもともと培養細胞の葉緑体DNA結合タンパク質として単離したタンパク質であるが,その1次構造の解析から,DNA結合ドメインとともに,アスパラギン酸プロテアーゼの活性ドメインをもつことが明らかとなった21)。すでにDNA結合性のプロテアーゼとしては大腸菌のLonプロテアーゼが知られており22),Lonは転写調節などに関与することから,CND41も葉緑体転写因子等を分解する可能性を期待した。しかし,プロテアーゼ活性の検討から,Lonプロテアーゼがセリンプロテアーゼであり,タンパク質の加水分解にATPを必要とするのに対し,CND41は酸性領域に至適pHを持ち,ATPを必要とはしないことが明らかとなった。また,葉緑体内のpHは中性から弱アルカリ性であることから,葉緑体内で実際に機能しているか疑問がもたれた。しかし,種々の条件検討の結果,至適pHは酸性にあるものの,ある種の基質,実際には変性したRubiscoに対して生理的pHにおいて強い分解活性を認めた(村上ら,未発表データ)。
これまでの研究でRubiscoの分解の要因の一つとして,活性酸素による分解の誘導が想定されているが,それに伴うRubiscoの変性が引き続く分解の引きがねとなることは十分想定できる。実際,CND41遺伝子のアンチセンス遺伝子を導入したタバコ植物は通常の植物より濃い緑色を示し,かつ老化が遅れる傾向を認めている(中野ら,未発表データ)。さらに,老化の引きがねの一つである糖(ショ糖)の添加によりその発現が顕著に誘導されることも,CND41が老化においてプロテアーゼとして機能していると考える上で合理的である。
一方,CND41は,プロテアーゼ活性とともにDNA結合性をもつ。Lonプロテアーゼの場合もDNAの存在によりプロテアーゼ活性が抑制されることが知られているが,CND41の場合にもDNAの添加によりプロテアーゼ活性が抑制される(村上ら,未発表データ)。想像力をたくましくすると,CND41は老化(機能変換)しつつある緑葉のなかの葉緑体中でタンパク質を分解する一方,その再生に必要なDNAを最後まで守るために機能しているのかもしれない。既に述べたように,転写に関わる配列は葉緑体機能分化に必須である。最近,大腸菌の中で,DNA結合タンパク質がDNAと結合することによりDNAを結晶化し,保護していることが明らかとなってきている23)。
CND41はDNA結合性とプロテアーゼ活性という二面性をもつが,プロプラスチドから葉緑体,あるいは葉緑体からアミロプラストへの変換,さらには葉緑体の分解(老化)時において,葉緑体の構造的改変とDNA保護機能の両面において機能しているのかもしれない。
前述のように環境ストレスにより植物の生長が阻害されることはよく知られているが, 葉緑体機能の阻害が細胞の形態形成に影響することも明らかになりつつある。 DAGとDCLはそれぞれキンギョソウとトマトから単離された葉緑体の発達に必須な遺伝子である24,25。 興味あることにこれら遺伝子はそれぞれ葉緑体移行シグナルをもつ比較的低分子量(25-26 kD)の可溶性タンパク質である。 これらの遺伝子の変異は葉緑体分化を初期のプロプラスチド段階に抑制するとともに,緑葉の柵状組織細胞の形態に異常を生じる。 DAG,DCLともに,葉以外の組織でも発現が認められるが, 変異による表現型の発現は葉のみに認められている。トウモロコシのIOJAP26)は同様に葉緑体分化の初期過程で働く遺伝子であるが, この変異では柵状組織の構造に変化は見られない。この違いは葉の展開に光が必要である双子葉植物と必要としない単子葉植物の違いかもしれないが, いずれにせよ,これら遺伝子の機能は未同定である。興味深いことに,DAGとDCLは極めて似た表現型を示す遺伝子であるが,相同性はまったく認められていない。柵状細胞の発達に影響を及ぼす遺伝子としてアラビドプシスのPALE CRESS (PAC)が知られている27)。このタンパク質も最近葉緑体に輸送されることが明らかとなっている28)。しかし,PACの場合,若い葉では変化は認められず,細胞間隙が開き,柵状組織が見られなくなるのは古い葉のみである。
動物には葉緑体はないが,ヒトの場合,ミトコンドリアゲノムの変異により広範囲な症状が認められ,特に,エネルギー代謝の盛んな臓器において,筋弱力,中枢神経症状を起こすことが知られている29)。一方,トウモロコシでもミトコンドリアの変異により極度の奇形が生じる30,31)が,何れの場合もミトコンドリアによるATP生産の低下によるものであると考えられる。この点,葉緑体の機能抑制による白化は必ずしも形態形成異常にはつながらず,むしろ,葉緑体から何らかのシグナルがでているものと考えられる。
では,どのような要因が考えられるであろうか? DAGやDCLによる細胞異常に似た現象が葉緑体コードのClpP遺伝子の破壊に関する研究から明らかになりつつある。Clpプロテアーゼは前述のLonプロテアーゼとともに大腸菌の主要プロテアーゼであり,その活性サブユニットClpP遺伝子が葉緑体ゲノムにコードされていることから近年関心を集めている32,33)。一方,調節サブユニットであるClpAのホモローグは核にコードされている。ClpAホモローグの一つであるERD1は乾燥ストレスにより誘導される遺伝子として単離されたことより,老化に関与するのではないかと考えられているが,一方,タンパク質レベルでの解析から否定的な報告も出されている34,25)。

図2 ClpP破壊株(a)においては、通常の植物体(b)では認められないような形態異常が若い葉で顕著に見られる(奈良先端大 鹿内利治博士原図、Plant Cell Physiol. 42:264-273 (2001)より引用)
一方,奈良先端大学の鹿内博士らは,近年開発された葉緑体形質転換系を用いて研究を進め,タバコの葉緑体ClpPの遺伝子を完全に破壊することはできないこと,また,部分的に破壊した株でも,若い組織において葉緑体や葉の形態異常が発生すること,葉緑体の異常は組織の成熟とともに軽減されるが,葉の異常は残ることなどを明らかとし,Clpプロテアーゼは葉緑体分化の初期過程において重要な役割を果たすと考えられる結果を得ている(図2)。DCLやDAG とはその異常の発生部位が異なるが,いずれにせよ,葉緑体が細胞形態形成の一つのシグナルの発信源であることは間違いない。

図3 CND41アンチセンス株における老化の遅延と矮性化
(理研 中野雄司博士原図)
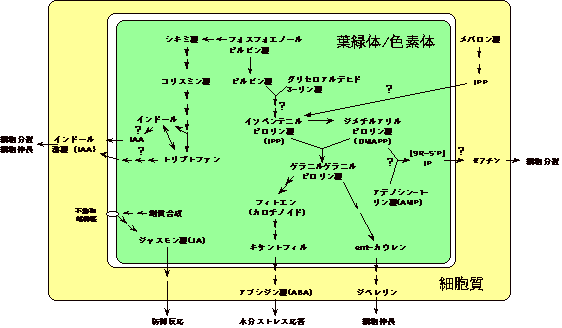
図4 葉緑体にあると考えられる植物ホルモン生合成反応
実際には不明の点が多く、特に、?は局在性、反応機構など不明である。ジャスモン酸の生合成は細胞膜でも起っていると考えられている。
葉緑体は植物細胞に固有の細胞内小器官であり,光合成を始めとする様々な機能を行なっている。これまでは光エネルギーを固定し,1次代謝基質を生産する機能が重視されてきたが,ホルモンを始めとする様々なシグナル分子の生合成にも関わっている。葉緑体の形質転換が可能となり,母性遺伝することから組換え遺伝子の拡散の危険が少ない葉緑体を細胞内工場として利用しようとする試みも急である。しかし,葉緑体の機能は多面的であり,そのポテンシャルは高いが,多くの除草剤のターゲットとなることが示すように,悪戯な改変が,その破壊(細胞死)に至る危険もある。葉緑体の分子細胞生物学が今,面白い所以である。
ここで紹介したCND41の非発表データは京都大学生命科学研究科全能性統御機構学分野ならびに農学研究科分子細胞育種学分野,理化学研究所植物機能学分野において行なわれたものであり,データの提供ならびに貴重な意見を頂戴した遠藤剛博士,中野雄司博士,村上真也博士に感謝します。また,ClpPに関して貴重な資料を提供していただいた奈良先端科学技術大学院大学鹿内利治博士にも心より感謝申し上げます。また,ここで紹介したCND41に関する研究は文部省特定領域研究「個体の光合成統御」の助成を受けたものである。
引用文献
1)Z. Naturforsch.
C., 48, Special Issue, Chloroplast metabolism and its inhibition by herbicides,
eds, Yoshida, S., Oettmeier, W., Boeger, P., pp119-405 (1993)
2)Konishi,
T., Sasaki, Y.: Proc. Natl. Acad. Sci. USA, 91, 3598-3601 (1994))
3)Hudson,
A., Carpenter, R., Doyle, S., Coen, E.S.:
EMBO J., 12, 3711-3719 (1993)
4)Wu, D.,
Wright, D.A., Wetzel, C. Voyatas, D.F., Rodermel, S.: Plant Cell, 11, 43-56
(1999)
5)Carol,
P., Stevenson, D., Bisanz, C, Breitenbach, J., Sandmann, G., Mache, R.,
Coupland, G., Kuntz, M.: Plant Cell, 11, 57-68 (1999)
6)Morden,
C.W., Wolfe, K.H., de Pamphilis, C.W, Palmer, J.D.: EMBO J., 10, 3281-3288
(1991)
7)Hess,
W.R., Prombona, A., Fieder, B., Subramanian, A.R., Borner, T.: EMBO J., 12,
563-571 (1993)
8)Pilgrim,
M.L., van Wijk, K.J., Parry, D.H., Sy, D.A., Hoffman, N.E.: Plant J., 13,
177-186 (1998)
9)Leon,
P., Arroyo, A., Mackenzie, S.: Annu. Rev. Plant Physiol. Plant Mol. Biol., 49,
453-480 (1998)
10)Allison,
L., Simon, L., Maliga, P.: EMBO J. 15, 2802-2809 (1996)
11)Willekens,
H., Chamnongpol, S., Davey, M., Schraudner, M., Langebartels, C., Van Montagu,
M., Inze, D., Van Camp W.: EMBO J., 16, 4806-4816 (1997)
12)Yamasaki,
H., Takahashi, S., Heshiki, R.: Plant Cell Physiol., 40, 640-646 (1999)
13)Tarczynsci,
M.C., Jensen, R.G., Bohnert, H.J.: Science, 259, 508-510 (1993)
14)Shikanai,
T., Takeda, T., Yamauchi, H., Sano, S.., Tomizawa, K., Yokota, A., Shigeoka,
S.: FEBS Lett., 428, 47-51 (1998)
15)Vierstra,
R.D.: Annu. Rev. Plant Physiol. Plant
Mol. Biol., 44, 385-410 (1993)
16)Nooden,
L.D., Guiamet, J.J., John, I.: Physiol. Plant., 101, 746-753 (1997)
17)Ishida,
H., Nishimori, Y., Sugisawa, M., makino, A., Mae, T.: Plant Cell Physiol., 38,
471-479 (1997)
18)
Desimone, M., wagner, E., Johanningmeier, U.: Planta, 205, 459-466 (1998)
19)Adam,
Z.: Plant Mol. Biol., 32, 773-783 (1996)
20)Andersson,
B., Aro, E.M.: Physiol Plant., 100, 780-793 (1997)
21)Nakano,
T., Murakami, S., Shoji, T., Yoshida, S., Yamada, Y., Sato, F.: Plant Cell, 9,
1673-1682 (1997)
22)Goldberg,
A.L.: Eur. J. Biochem., 203, 9-23 (1992)
23)Wolf,
S.G., Frenkiel, D., Arad, T., Finkel, S.E., Kolter, R., Minsky, A.: Nature,
400, 83-85 (1999)
24)Keddie,
J.S., Carroll, B., Hones, J.D.G., Gruissem, W.: EMBO J., 15, 4208-4217 (1996)
25)Chatterjee,
M., Sparvoli, S., Edmunds, C., Garosi, P., Findlay, K., Martin, C.: EMBO J.,
15, 4194-4207 (1996)
26)Han,
C-d., Coe, E.H., Martienssen, R.A.: EMBO J., 11, 4037-3046 (1992)
27)Reiter,
R.S., Coomber, S.A., Bourett, T.M., Bartley, G.E., Scolnik, P.A.: Plant Cell,
6, 1253-1264 (1994)
28)Tirlapur,
U.K., Dahse, I., Reiss, B., Meurer, J., Oelmuller, R.: Eur. J. Cell Biol., 78, 233-240 (1999)
29)Wallace,
D.C.: Trends Genet., 5, 9-13 (1989)
30)Newton,
K.J. and Coe, E.H.: Proc. Natl Acad. Sci. USA, 83, 7363-7366 (1986)
31)Sakamoto,
W., Kondo, H., Murata, M., and Motoyshi, F.:
Plant Cell, 8, 1377-1390 (1996)
32)Sokolenko,
A., Lerbs-Mache, S., Altschmied, L., Herrmann, R.G.: Planta, 207, 286-295
(1998)
33)Clarke,
A.K.: Ann. Bot., 83, 593-599 (1999)
34)Nakashima,
K., Kiyosue, T., Yamaguchi-Shinozaki, K., Shinozaki, K.: Plant J., 12, 851-861
(1997)
35)
Weaver, L.M., Froehlich, J.E., Amasino, R.M.:
Plant Physiol., 119, 1209-1216 (1999)
36)瀬尾光範,赤羽修一,小柴共一: 植物化学調節, 34, 47ー54(1999)
37)Barbier-Brygoo,
H., Joyard, J., Pugin, a., Ranjeva, R.: Trends Plant Sci, 2, 214-222 (1997)
追記
図2の結果は
Shikanai, T., Shimizu, K. Ueda, K., Nishimura, Y., Kuroiwa, T., Hashimoto, T.:
Plant Cell Physiol, 42, 264-273 (2001)に掲載されている。